(IME) Num recipiente fechado,mantido a temperatura constante de 700 K,foram introduzidos 0,450 mol de dióxido de carbono e 0,450 mol de hidrogênio.Após certo tempo,estabeleceu-se o equilíbrio,aparecendo como espécies novas monóxido de carbono e vapor de água.Foram então, adicionados 0,500 mol de uma mistura equimolecular dos reagentes.Calcule a nova composição de equilíbrio,sabendo-se que nessas condições 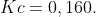
- Spoiler:
- 0,500 de
e
;0,200 de
e












 , temos o seguinte valor de
, temos o seguinte valor de  :
:
 ,
,  , isso não convém. Portanto, para
, isso não convém. Portanto, para  temos os seguintes valores no equilíbrio:
temos os seguintes valores no equilíbrio:





 .
.







» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl