Observe o esquema representativo da eletrólise de solução aquosa de fluoreto de sódio e assinale a alternativa correta

a) A semirreação que ocorre no catodo é igual a
2H2O(l) + 2e- ---> H2(g) + 2(OH)-(aq)
b) A semirreação que ocorre no ânodo é igual a
2F-(aq) ---> F2(g) + 2e-
c) Trata-se da eletrólise da água, e os produtos obtidos (formados) são H2 no tubo B e O2 no tubo A.
d) Após certo tempo de eletrólise, a solução estará ácida.
e) Trata-se da eletrólise do fluoreto de sódio.
Desde já agradeço!

a) A semirreação que ocorre no catodo é igual a
2H2O(l) + 2e- ---> H2(g) + 2(OH)-(aq)
b) A semirreação que ocorre no ânodo é igual a
2F-(aq) ---> F2(g) + 2e-
c) Trata-se da eletrólise da água, e os produtos obtidos (formados) são H2 no tubo B e O2 no tubo A.
d) Após certo tempo de eletrólise, a solução estará ácida.
e) Trata-se da eletrólise do fluoreto de sódio.
Desde já agradeço!








 OH –
OH –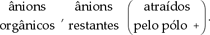






» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl