 por Tiago Reis Seg Jul 25, 2011 6:27 pm
por Tiago Reis Seg Jul 25, 2011 6:27 pm
Reação de um metal com ácido forma gás hidrogênio. Sendo assim temos na equação:
} + HCl_{(l)}\rightarrow H_{2}_{(g)} + AlCl_{3}_{(s)})
Como não temos nenhuma ideia prévia dos valores da quantidade que reage e que forma, recorremos ao valor de calor de combustão. Sabendo-se que a reação do gás produzido na reação anterior ante uma reacão de combustão libera 2040,0 kcal, e que a formação de um mol de água líquida é 68 kcal, temos:
} + O_{2} \to H_{2}O + \Delta H)
Onde 1 mol de
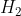
libera 68 kcal. Dessa forma basta fazer uma regra de três:
1 mol de
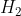
- -- - - - - -- - 68 kcal
x mols -- - -- - - -- - - 2040,0 kcal.
x = 2040/68
x= 30 mols de H2
Balanceando agora a reação anterior, temos:
} + 6HCl_{(l)}\rightarrow 3H_{2}_{(g)} + 2AlCl_{3}_{(s)})
2 mols de Al equivalem a 2*27 = 54 g
Portanto temos que:
54g de Al - - - - - -- 3 mol de H2
xg de Al - - - - - -- - 30 mol de H2
x = 30*54/3
x= 540 g
Ou seja, 540 g de Alumínio reagiram formando 30 mols de H2
Para calcular a impureza (matéria que não reagiu) basta fazer outra regra de três:
600 g - - - - 100%
540g - - - - - -x%
x% = 540*100/600
x% = 54000/600 ==>
x% = 90% de pureza












» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl
» Natural lipstick helps male monkeys get the girl